日々の細胞培養において、従来のCO2インキュベーターではどうしても超えられない「壁」を感じたことはありませんか?
特に再生医療や幹細胞研究の分野では、細胞の増殖効率や分化能の維持が大きな課題となります。
実は、私たちが呼吸している大気中の酸素濃度(約21%)は、体内の細胞にとっては「酸素過多」であり、ストレス環境になり得るのです。
本記事では、生体内環境をより忠実に再現し、細胞本来の能力を引き出すための「マルチガスインキュベーターの活用法」について解説します。
科学的根拠に基づいた酸素濃度設定から、実験の再現性を高める運用ノウハウ、そして機種選定のポイントまで、現場ですぐに役立つ情報を網羅しました。
低酸素培養をマスターし、研究成果を次のステージへと進めていきましょう。
マルチガスインキュベーター活用の結論:生体内環境(低酸素)の再現による培養品質の最大化
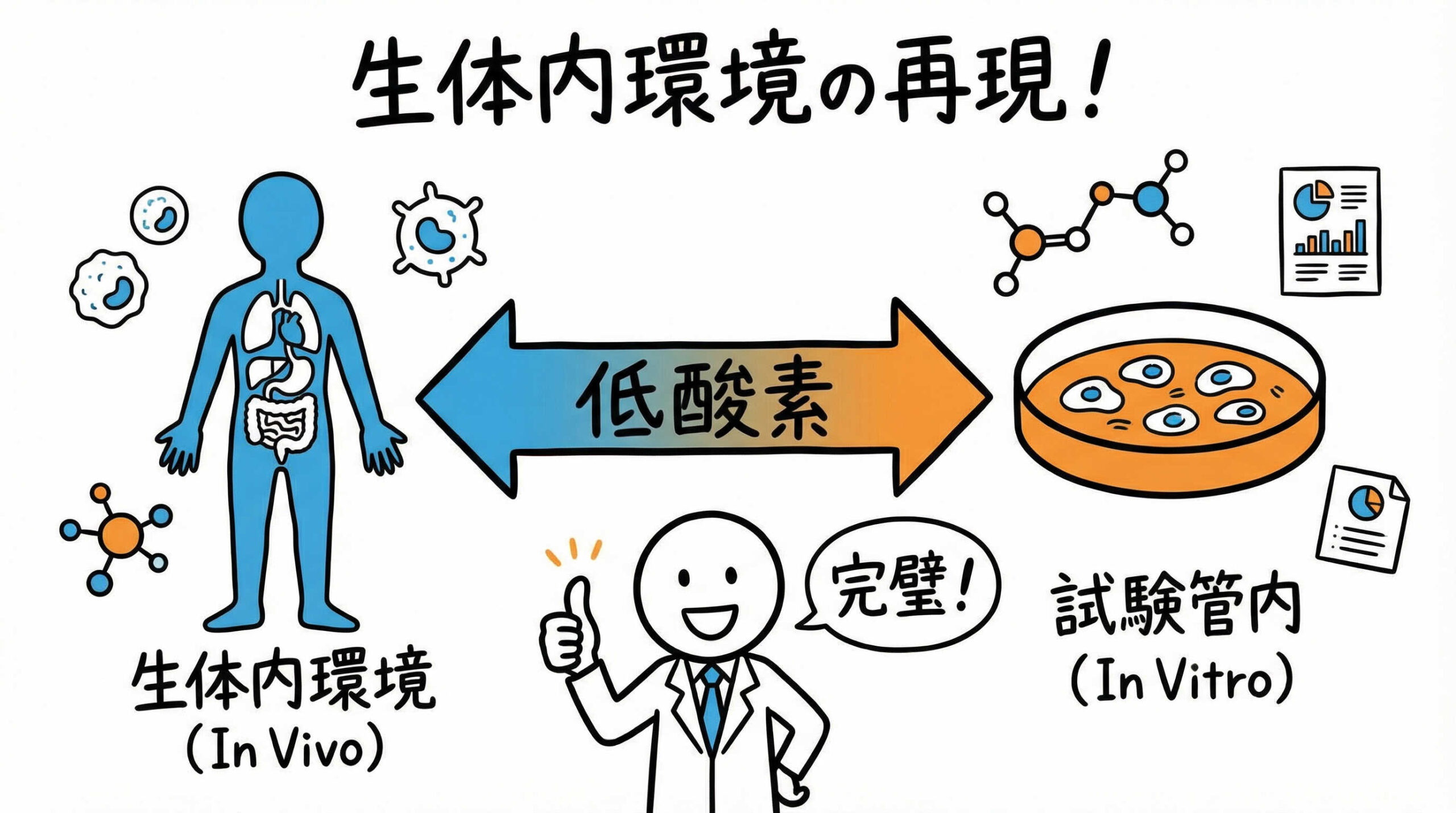
再生医療の研究開発において、細胞培養環境の最適化は成功の鍵を握る重要な要素です。
特に注目されているのが、マルチガスインキュベーターを用いた「低酸素培養」です。
これは単なる流行ではなく、細胞生理学に基づいた合理的なアプローチと言えるでしょう。
ここでは、なぜ今マルチガスインキュベーターが必要とされるのか、その本質的な理由とメリットについて掘り下げていきます。
従来のCO2インキュベーターとマルチガスインキュベーターの決定的な違い
一般的なCO2インキュベーターとマルチガスインキュベーターの最大の違いは、制御できるガスの種類にあります。
CO2インキュベーターは温度とCO2濃度のみを制御し、酸素濃度は大気と同じ約21%に依存します。
一方、マルチガスインキュベーターは窒素(N2)ガスを供給することで庫内の酸素濃度を低下させ、1%〜20%程度の範囲で任意に制御することが可能です。
この機能により、生体内の低酸素環境をインビトロ(試験管内)で再現できるようになります。
生体内酸素濃度(Physiological Hypoxia)が細胞に与えるポジティブな影響
「低酸素」と聞くと、細胞にとって過酷な環境をイメージされるかもしれません。
しかし、生体内の組織は血管から酸素供給を受けており、その濃度は臓器や組織によって異なりますが、概ね2%〜9%程度(Physiological Hypoxia)です。
つまり、細胞にとってはこの「低酸素」こそが、本来あるべき正常な環境なのです。
この環境を再現することで、細胞はストレスから解放され、より生体内に近い挙動を示すようになります。
再生医療研究において低酸素培養がスタンダードになりつつある背景
かつては特殊な実験系と見なされていた低酸素培養ですが、現在は再生医療研究におけるスタンダードになりつつあります。
その背景には、iPS細胞や間葉系幹細胞(MSC)などの幹細胞を用いた治療法の開発が進み、より高品質で安全な細胞加工物が求められていることがあります。
細胞の品質を担保し、臨床応用への橋渡しをスムーズに行うためには、培養段階から生体内環境に近づけることが不可欠となっているのです。
培養効率が上がらない理由は「酸素毒性」?マルチガスインキュベーター導入の科学的根拠
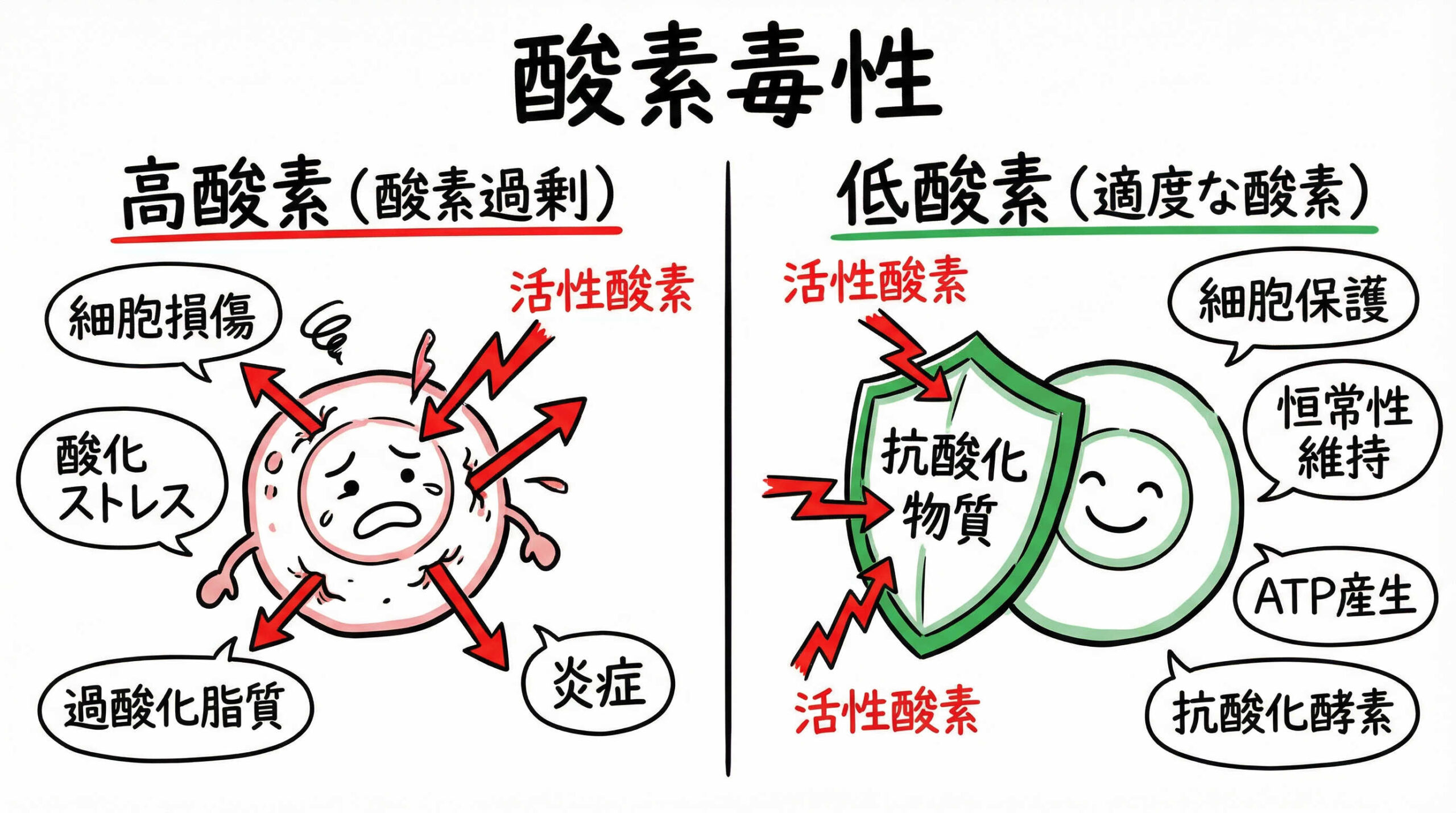
「温度も培地も完璧なのに、なぜか細胞の状態が良くない」
そんな時は、酸素濃度が原因である可能性を疑ってみるべきかもしれません。
大気レベルの酸素濃度が細胞に与える影響は、私たちが想像する以上に大きいものです。
ここでは、マルチガスインキュベーターを導入すべき科学的な根拠について、分子レベルのメカニズムを交えて解説します。
大気レベルの酸素濃度(約21%)が引き起こす活性酸素種(ROS)の蓄積
通常の大気中酸素濃度(約21%)での培養は、生体内(約2-9%)と比較して高酸素状態にあります。
この過剰な酸素は、ミトコンドリアでの代謝過程において活性酸素種(ROS)の産生を増加させます。
蓄積されたROSはDNA、タンパク質、脂質を酸化させ、細胞にダメージを与える「酸素毒性」を引き起こす原因となります。
低酸素培養は、このROSの発生を抑制し、酸化ストレスから細胞を守る有効な手段です。
細胞老化(Senescence)の抑制と増殖能の維持
酸化ストレスの蓄積は、細胞老化(Senescence)を加速させる主要な要因の一つです。
特に長期培養が必要な場合、高酸素環境下ではテロメアの短縮が早まり、細胞の増殖能力が早期に低下してしまうことが報告されています。
マルチガスインキュベーターを用いて適切な低酸素環境を維持することで、細胞老化を遅らせ、高い増殖能を長期間維持することが可能になります。
これは、大量の細胞が必要となる再生医療において極めて重要なメリットです。
HIF(低酸素誘導因子)経路の活性化と遺伝子発現への影響
低酸素環境は、HIF(低酸素誘導因子)という転写因子の安定化を通じて、細胞の遺伝子発現パターンを大きく変化させます。
HIFは、解糖系酵素や血管新生因子(VEGFなど)の発現を誘導し、細胞の代謝をミトコンドリア呼吸から解糖系へとシフトさせます。
この代謝リプログラミングは、幹細胞の未分化性維持や生存率向上に深く関与しており、細胞本来の機能を制御する上で重要な役割を果たしています。
幹細胞の未分化性維持における低酸素環境の優位性
ES細胞やiPS細胞、間葉系幹細胞(MSC)などの幹細胞は、低酸素環境(ニッチ)に存在しています。
研究により、低酸素培養下ではこれらの幹細胞の「幹細胞性(Stemness)」、すなわち未分化状態の維持や多分化能がより良好に保たれることが明らかになっています。
自然発生的な分化を抑制し、均質な細胞集団を得るためには、酸素濃度の厳密なコントロールが欠かせません。
【細胞種別】マルチガスインキュベーターの具体的な酸素濃度設定と活用事例
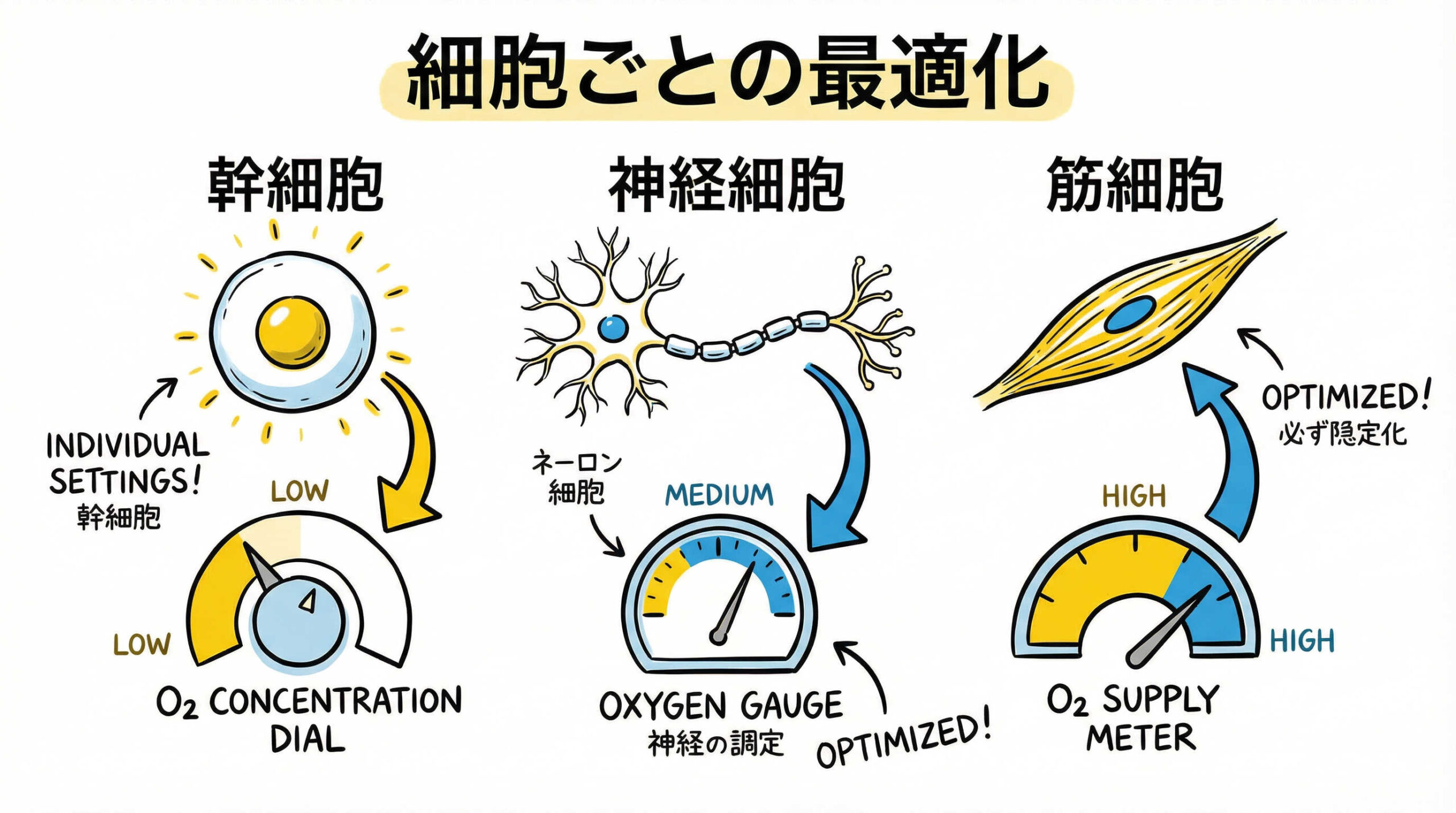
マルチガスインキュベーターの効果を最大限に発揮するためには、対象とする細胞種に合わせて最適な酸素濃度を設定することが重要です。
一概に「低酸素」と言っても、細胞の由来や目的によって最適な条件は異なります。
主要な細胞種における推奨設定と、期待される効果について具体的に見ていきましょう。
iPS細胞・ES細胞:未分化維持とゲノム安定性のための酸素濃度設定
ヒトiPS細胞やES細胞の培養では、一般的に2%〜5%程度の酸素濃度が推奨されます。
この条件下では、染色体の安定性が向上し、遺伝子変異のリスクが低減するという報告があります。
また、ナイーブ型への変換や維持においても低酸素環境が有利に働くことが知られており、高品質なiPS細胞ストックを構築する上で、マルチガスインキュベーターは必須のツールと言えるでしょう。
間葉系幹細胞(MSC):増殖スピード向上と分化能維持の最適条件
骨髄や脂肪由来の間葉系幹細胞(MSC)は、再生医療の主役として注目されています。
MSCの場合、2%〜5%の低酸素環境下で培養することで、増殖スピード(Doubling Time)が短縮され、より効率的に細胞数を増やすことができます。
さらに、軟骨や骨への分化誘導効率が向上するケースも報告されており、治療用細胞の製造プロセスにおいて低酸素培養の導入が進んでいます。
神経幹細胞・神経細胞:酸化ストレスからの保護と生存率向上
神経系の細胞は酸化ストレスに対して非常に脆弱であるため、高酸素環境での培養は生存率の低下を招きやすい傾向にあります。
神経幹細胞や神経細胞の培養では、3%〜5%程度の低酸素環境を設定することで、細胞死(アポトーシス)を抑制し、ニューロンへの分化や神経突起の伸長を促進する効果が期待できます。
神経変性疾患の研究モデル構築においても、低酸素環境の再現は重要です。
がん細胞・腫瘍塊:生体内の微小環境(Tumor Microenvironment)の再現
がん研究においては、腫瘍内部の微小環境(Tumor Microenvironment)を再現することが重要です。
固形がんの内部は血管新生が追いつかず、重度の低酸素状態(1%以下になることも)にあります。
マルチガスインキュベーターでこの環境を再現することで、がん細胞の浸潤・転移能や、抗がん剤に対する薬剤耐性をより正確に評価することが可能になります。
実験の再現性を高めるマルチガスインキュベーターの運用・管理ノウハウ
高性能な機器を導入しても、運用方法が適切でなければ期待通りの結果は得られません。
特に低酸素培養では、窒素ガスの管理や環境復帰時間など、通常の培養以上に気を配るべきポイントがあります。
実験の再現性を高め、トラブルを未然に防ぐための実践的な運用・管理ノウハウを紹介します。
窒素(N2)ガス供給ラインの確保と安全管理
低酸素環境を作るためには、窒素(N2)ガスを継続的に供給する必要があります。
研究室の安全管理として、万が一のガス漏れに備え、酸素濃度計や酸欠アラームを設置し、十分な換気を行うことが必須です。
また、ボンベの残量管理も重要です。実験中のガス切れは培養環境の激変を招くため、予備ボンベを常に確保し、定期的なチェックをルーチン化しましょう。
扉開閉後のガス濃度復帰時間(リカバリータイム)の考慮
インキュベーターの扉を開閉すると、庫内のガス環境は大気と混ざり合い、設定値から乖離します。
特に低酸素設定の場合、設定濃度に戻るまでの時間(リカバリータイム)が長くなる傾向があります。
扉の開閉回数と時間を最小限に抑えることはもちろん、リカバリー性能の高い機種を選ぶことも重要です。
実験計画を立てる際は、この復帰時間を考慮に入れ、環境変動を最小限にする工夫が求められます。
O2センサー(ジルコニア式・ガルバニ電池式)の特性理解と校正頻度
酸素濃度を正確に制御するためには、O2センサーの精度が命です。
主に「ジルコニア式」と「ガルバニ電池式」がありますが、それぞれ特性が異なります。
ジルコニア式は精度が高く長寿命ですが、高価です。ガルバニ電池式は安価ですが、経時劣化するため定期的な交換が必要です。
使用する機種のセンサータイプを把握し、メーカー推奨の頻度で必ず校正(キャリブレーション)を行いましょう。
コンタミネーションリスクを低減させるための庫内環境維持
マルチガスインキュベーター内は高湿度に保たれているため、カビや細菌の温床になりやすい環境です。
特に低酸素培養では培地交換の頻度や細胞の代謝が変わることもあり、コンタミネーションへの警戒が必要です。
定期的な庫内の清掃・滅菌はもちろん、加湿水の交換頻度を守り、銅合金などの抗菌性素材を使用した内装を持つ機種を活用するのも一つの手です。
培地交換時の低酸素暴露を防ぐためのワークステーションとの連携
盲点になりがちなのが、培地交換や観察のためにインキュベーターから細胞を取り出している時間です。
この間、細胞は高酸素(大気)に暴露され、再びストレスを受けます(Reoxygenation)。
厳密な低酸素実験を行う場合は、低酸素ワークステーション(グローブボックス型)内で操作を行うか、あるいは手早く操作を済ませて速やかにインキュベーターに戻すなど、暴露時間を極限まで短くする対策が必要です。
再生医療現場における機種選定のポイントとコストパフォーマンス

これからマルチガスインキュベーターを導入、あるいは買い替えを検討されている方にとって、機種選定は悩ましい問題でしょう。
スペック表を見るだけでは分からない、実際の使い勝手やランニングコストも重要な判断基準です。
再生医療の現場視点で、長期的に見て「失敗しない」選定のポイントを整理しました。
厳密な環境制御が可能なドライヒート滅菌機能の有無
再生医療グレードの細胞培養では、コンタミネーションのリスクをゼロに近づけることが求められます。
そのため、薬剤を使わずに庫内を完全に滅菌できる「ドライヒート滅菌(乾熱滅菌)」機能の有無は重要なチェックポイントです。
160℃〜180℃程度の高温で定期的に滅菌できる機種であれば、安心して長期培養を継続することができ、メンテナンスの手間も大幅に軽減されます。
複数のガスボンベ自動切替機能による培養中断リスクの回避
低酸素培養では窒素ガスを大量に消費するため、週末や夜間にボンベが空になるリスクがあります。
これを防ぐために、「ガスボンベ自動切替器(チェンジャー)」が接続可能か、あるいは内蔵されているかを確認しましょう。
片方のボンベが空になった瞬間に自動で予備ボンベに切り替わる機能があれば、培養中断の事故を防ぎ、研究者の精神的な負担も減らすことができます。
小分割扉による環境変動の最小化
扉の開閉による環境変化を最小限にするために、内扉が小さく分割されている「小分割扉」タイプの機種が推奨されます。
必要な棚の扉だけを開けることで、庫内全体のガス流出や温度低下を防ぐことができます。
これにより、ガス濃度や温度の復帰時間が短縮されるだけでなく、窒素ガスの消費量を抑える効果もあり、実験精度とコストの両面でメリットがあります。
ランニングコストに直結する窒素ガスの消費効率
マルチガスインキュベーターの運用で最もコストがかかるのが窒素ガスです。
密閉性が高く、ガスの消費効率が良い機種を選ぶことは、長期的なランニングコスト削減に直結します。
カタログスペックだけでなく、実際のガス消費量データなどをメーカーに問い合わせて比較することをお勧めします。
初期費用が多少高くても、ガス消費が少ない機種の方がトータルコストでは安くなる場合が多いのです。
まとめ

マルチガスインキュベーターを用いた低酸素培養は、もはや特殊な実験手法ではなく、再生医療研究における必須のスタンダードとなりつつあります。
細胞にかかる酸素毒性を排除し、生体内環境(Physiological Hypoxia)を再現することで、細胞の増殖能、未分化維持、そして分化効率を飛躍的に向上させることが可能です。
導入にあたっては、以下のポイントを再確認しましょう。
- 目的の明確化: 細胞種に合わせた最適な酸素濃度の設定
- 運用管理の徹底: センサー校正、ガス管理、コンタミ対策
- 適切な機種選定: 滅菌機能、ガス消費効率、操作性のバランス
研究の再現性を高め、臨床応用を見据えた高品質な細胞を得るために、ぜひマルチガスインキュベーターを有効に活用してください。
マルチガスインキュベーターの活用法についてよくある質問

以下に、マルチガスインキュベーターの導入や運用に関して、研究者の方々からよく寄せられる質問をまとめました。
-
マルチガスインキュベーターとCO2インキュベーターの主な違いは何ですか?
- CO2インキュベーターは温度とCO2濃度のみを制御しますが、マルチガスインキュベーターは窒素ガスを供給することで酸素濃度も制御(低酸素化)できる点が決定的に異なります。
-
一般的な細胞培養での推奨酸素濃度はどのくらいですか?
- 細胞種によりますが、多くの生体組織を模倣する場合、2%〜5%程度が一般的です。iPS細胞やMSCなどではこの範囲で良好な結果が多く報告されています。
-
窒素ガスの消費量はどのくらいですか?
- 機種や設定濃度、扉の開閉頻度、気密性に大きく依存します。一般的に低酸素設定が低いほど、また開閉が多いほど消費量は増えます。ランニングコストを試算する際はメーカーに目安を確認することをお勧めします。
-
既存の実験室にそのまま導入できますか?
- 基本的には可能ですが、窒素ガスボンベの設置スペースと配管、および酸欠防止のための十分な換気設備や酸素濃度計の設置など、安全対策が必要です。
-
O2センサーの寿命はどのくらいですか?
- センサーの種類によります。ガルバニ電池式は化学反応を利用するため2〜3年程度で交換が必要になることが多いです。ジルコニア式は長寿命ですが、定期的な校正は必要です。
<script type="application/ld+json">
{
"@context": "https://schema.org",
"@type": "FAQPage",
"mainEntity": [
{
"@type": "Question",
"name": "マルチガスインキュベーターとCO2インキュベーターの主な違いは何ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "CO2インキュベーターは温度とCO2濃度のみを制御しますが、マルチガスインキュベーターは窒素ガスを供給することで酸素濃度も制御(低酸素化)できる点が決定的に異なります。"
}
},
{
"@type": "Question",
"name": "一般的な細胞培養での推奨酸素濃度はどのくらいですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "細胞種によりますが、多くの生体組織を模倣する場合、2%〜5%程度が一般的です。iPS細胞やMSCなどではこの範囲で良好な結果が多く報告されています。"
}
},
{
"@type": "Question",
"name": "窒素ガスの消費量はどのくらいですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "機種や設定濃度、扉の開閉頻度、気密性に大きく依存します。一般的に低酸素設定が低いほど、また開閉が多いほど消費量は増えます。ランニングコストを試算する際はメーカーに目安を確認することをお勧めします。"
}
},
{
"@type": "Question",
"name": "既存の実験室にそのまま導入できますか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "基本的には可能ですが、窒素ガスボンベの設置スペースと配管、および酸欠防止のための十分な換気設備や酸素濃度計の設置など、安全対策が必要です。"
}
},
{
"@type": "Question",
"name": "O2センサーの寿命はどのくらいですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "センサーの種類によります。ガルバニ電池式は化学反応を利用するため2〜3年程度で交換が必要になることが多いです。ジルコニア式は長寿命ですが、定期的な校正は必要です。"
}
}
]
}
</script>